Alkeny
Alkeny – uhlovodíky které v otevřeném řetězci mají jednu dvojnou vazbu.
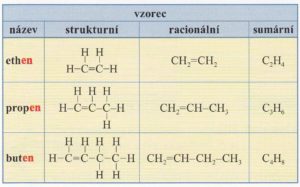
Názvosloví alkenů
- alkeny mají vždy zakončení -en
- obecný vzorec alkenů je CnH2n
- některé alkeny mají triviální (historické) názvy (např. ethen CH2 = CH2 má triviální název ethylen)
- nejjednodušší dva alkeny jsou ethen (ethylen) CH2=CH2, a propen (propylen) CH3-CH=CH2
Fyzikální vlastnosti alkenů
- podobné vlastnostem alkanů
- pro alkeny se dříve používalo označení olefiny
- mají vyšší body tání a nižší body varu než jim odpovídající alkany
- čím je řetězec uhlovodíku delší tím vyšší jsou jeho teploty tání a varu
- existují mezi nimi výhradně kovalentní vazby, které mají nepolární charakter
- nerozpustné ve vodě
- rozpustné v organických rozpouštědlech
- nevedou elektrický proud
Chemické vlastnosti alkenů
- čisté alkeny snadno zápalné a na vzduchu hořlavé
- dokonalým spalováním alkenů vzniká oxid uhličitý a voda – při této reakci vzniká velké množství tepla (zdroj energie) C2H4 + 3 O2 → 2 CO2 + 2 H2O
- při nedokonalém spalování uhlovodíků vzniká prudce jedovatý oxid uhelnatý (únik může způsobit otravu) C2H4 + 2 O2 → 2 CO + 2 H2O
- větší chemická reaktivita než u alkanů (příčinou je dvojná vazba)
Typickou reakcí alkenů je adice – na každý z uhlíkových atomů dvojné vazby se naváže atom či skupina atomů a dvojná vazba zaniká.
např. 
Při vysoké teplotě a tlaku + katalyzátor je možné alkeny polymerovat (spojuje se mnoho molekul alkenů a vzniká polymer).
Josef ŠIBOR, Irena PLUCKOVÁ, Jiří MACH: Chemie pro 9. ročník – Úvod do obecné a organické chemie, biochemie a dalších chemických oborů, 3. vyd. Brno: Nová škola, s. r. o., 2015. ISBN 978-80-7289-674-5
http://e-chembook.eu/alkeny-a-cykloalkeny
