Stavba molekul organických sloučenin
Vaznost – udává počet vazeb, které atom prvku v molekule sloučeniny vytvoří se sousedními atomy
Např. uhlík je vždy čtyřvazný!
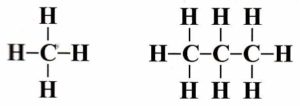
- ve sloučeninách mají atomy přesně danou vaznost
- atomy uhlíku se mohou vázat s dalšími prvky (přehled viz tab.)
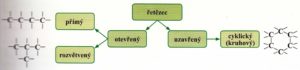
- atomy uhlíku mohou tvořit různě dlouhé řetězce a cykly
- řetězce mohou být různě rozvětvené (viz. nákres 1)
- mezi atomy uhlíku mohou být vazby jednoduché, dvojné a trojné (viz. nákres 2)

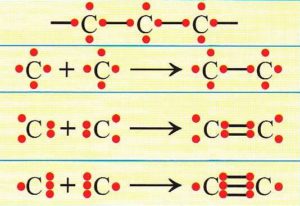
jednoduchá vazba – dva atomy C spojuje jeden pár elektronů
dvojná vazba – spojují se dvěma páry elektronů
trojná vazba – spojují se třemi páry elektronů
PPS
perioda – číslo periody označuje počet elektronových vrstev v obalu atomu
skupina – číslo skupiny, ve které prvek leží, označuje počet elektronů ve valenční vrstvě
valenční elektron – je elektron v elektronovém obalu umístěný v energeticky nejvýše položené (tzv. valenční) vrstvě (příp. několika vrstvách). Jde tedy o elektrony z posledních, největších orbitalů v rámci elektronové konfigurace atomu. Orbitaly obsahující valenční elektrony pak nazýváme valenční orbitaly. Tyto elektrony (resp. orbitaly) přijdou nejsnáze do kontaktu s jinými atomy a jejich valenčními elektrony (orbitaly), a díky tomu se mohou podílet na vzniku chemických vazeb mezi atomy. Elektronová konfigurace valenčních elektronů je pak z hlediska chemie nejdůležitější charakteristika atomu konkrétního prvku. Počet elektronů ve valenční slupce je specifický pro daný chemický prvek – podle něj jsou prvky rozděleny do sloupců periodické tabulky – ty označujeme jako skupiny. Počet valenčních elektronů většinou určuje maximální oxidační číslo atomu. Skupiny prvků v periodické soustavě jsou klasicky číslovány jako I.A až VIII.A a I.B až VIII.B – zde odpovídá číslo skupiny počtu valenčních elektronů (s výjimkou části skupiny VIII.B a skupin I.B a II:B). Modernější očíslování skupin 1 až 18 s počtem valenčních elektronů souvisí jen u menší části prvků.
Většina chemických látek se skládá ze sloučených atomů, které jsou k sobě vázány silami (tzv. chemickou vazbou) a vytvářejí molekuly.
Zjednodušeně můžeme říci, že chemická vazba vznikne spojením atomů pomocí valenčních elektronů.
Josef ŠIBOR, Irena PLUCKOVÁ, Jiří MACH: Chemie pro 9. ročník – Úvod do obecné a organické chemie, biochemie a dalších chemických oborů, 3. vyd. Brno: Nová škola, s. r. o., 2015. ISBN 978-80-7289-674-5
https://cs.wikipedia.org/wiki/Valen%C4%8Dn%C3%AD_elektron
