Chemická vazba
(výpisek z učebnice a jiné zajímavosti pro žáky k probíranému tématu)
- všechny chemické látky jsou složeny z atomů
- jen málo látek tvoří jednotlivé atomy
- většina chemických látek je složena z molekul (2 a více sloučených atomů)
- atomy v molekulách jsou k sobě vázány silami které nazýváme chemická vazba
- molekuly mají nižší energii než jednotlivé atomy, a proto jsou stálejší
- např. molekula H2 je stálejší než atom vodík H
Zjednodušeně můžeme říci, že:
chemická vazba vznikne spojením atomů pomocí valenčních elektronů.
Elektronegativita
- značka (X)
- schopnost atomu přitahovat elektrony chemické vazby
- hodnoty elektronegativity nalezneme v periodické soustavě prvků
- čím je elektronegativita vyšší tím více atom přitahuje elektrony chemické vazby ke svému jádru
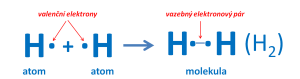
Vzniku molekuly vodíku
Vzniku molekuly chloru
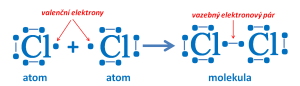
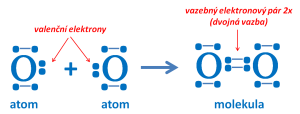
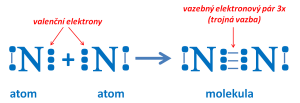
- chemickou vazbu mohou tvořit i dva vazebné elektronové páry nebo tři vazebné elektronové páry
Vznik molekuly kyslíku
Vznik molekuly dusíku
Na co umět odpovědět:
|
CITACE: viz. odkaz [k. 3 – chemie], [obrm. 76 – H2 vazba], [obrm. 77 – Cl2 vazba], [obrm. 78 – O2 vazba], [obrm. 79 – N2 vazba]
