Elektrolýza
Látky které vedou elektrický proud se nazývají – vodiče.
Chemické látky které obsahují polární nebo iontovou vazbu se v roztoku štěpí na ionty. Roztoky těchto látek vedou elektrický proud.
Roztok kyseliny, hydroxidu nebo soli (i taveniny), který vede elektrický proud se nazývá – elektrolyt. Vodivost elektrolytu způsobují ionty, které v roztoku vzniknou při elektrolytické disociaci (štěpení molekul sloučenin na ionty).
| Vodiče – jsou látky které vedou elektrický proud.
Elektrolyt – je roztok kyseliny, hydroxidu nebo soli (i taveniny), který vede elektrický proud. Vodivost elektrolytu způsobují ionty, které v roztoku vzniknou při elektrolytické disociaci. |
Elektrolýza – redoxní reakce, které probíhají na elektrodách při průchodu stejnosměrného elektrického proudu roztokem nebo taveninou. Elektrolýza neprobíhá samovolně, je třeba dodat elektrickou energii.
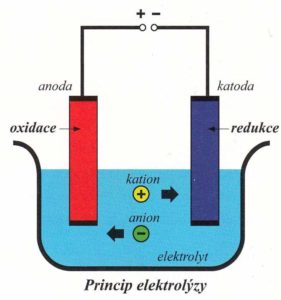
anoda – kladná elektroda – jsou k ní přitahovány záporně nabité ionty (anionty), dochází na ní k oxidaci
katoda – záporná elektroda – jsou k ní přitahovány kladně nabité ionty (kationty), dochází na ní k redukci
Příklad: Elektrolýza chloridu měďnatého
 vznik iontů – ionizace: CuCl2 –› Cu2+ + 2 Cl–
vznik iontů – ionizace: CuCl2 –› Cu2+ + 2 Cl–
reakce na katodě (redukce): Cu2+ + 2 e- –› Cu
reakce na anodě (oxidace): 2Cl– – 2 e- –› Cl2
rovnice probíhající reakce: Cu2+ + 2 Cl– → Cu0+ Cl20
| Elektrolýza – redoxní reakce, které probíhají na elektrodách při průchodu stejnosměrného elektrického proudu roztokem nebo taveninou. Elektrolýza neprobíhá samovolně, je třeba dodat elektrickou energii.
|
Průmyslové využití elektrolýzy
Průmyslové využití elektrolýzy
|
Na co umět odpovědět:
|
CITACE: viz. odkaz: [k. 1 – chemie], [k. 2 – chemie]
http://www.komenskeho66.cz/materialy/chemie/WEB-CHEMIE9/elektrolyza.html
