Redoxní reakce jako zdroj energie
Italský fyziolog Luigi Galvani (1737-1798) se zabýval studiem anatomii živočichů. při pokusech s preparáty svalů žab, zjistil že se při dotyku bimetalovým páskem stahují (tzv. živočišná elektřina).
Dalšími pokusy pokračoval italský fyzik Alessandr Volt který zjistil, že mezi dvěma kovy spojenými kapalným vodičem vzniká elektrické napětí (galvanizmus). Sestrojil první galvanický článek (tzv. Voltův sloup).
Galvanický článek
Galvanický článek – je zdroj ze kterého se na základě redoxní reakce získává elektrický proud.
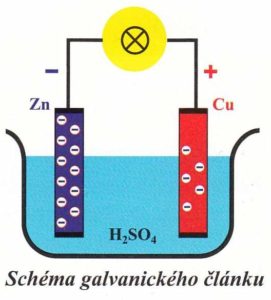
Skládá se:
- elektrolytu (např. zředěná kyselina sírová)
- katody (např. zinek)
- anody (např. měď)
Mezi oběma elektrodami vzniká napětí. Jeho vznik dokážeme např. připojením žárovky.
Nejznámějším galvanickým článkem je tzv. suchý článek
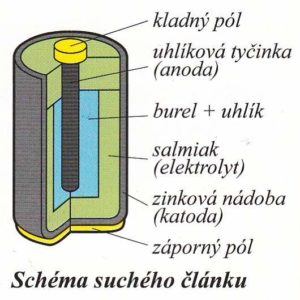
Skládá se:
- elektrolytu (směs oxidu manganičitého a chloridu amonného)
- katody (zinkový obal)
- anody (uhlíková tyčinka)
Článek se po určité době vyčerpá (díky průběhu elektrochemických reakcí).

Některé galvanické články (např. akumulátory – autobaterie) se dají znovu nabít a použít opakovaně.
| Galvanický článek – je zdroj ze kterého se na základě redoxní reakce získává elektrický proud.
Skládá se:
|
| Tzv. suchý článek
Skládá se:
|
| Nejznámějším galvanickým článkem je tzv. suchý článek.
Některé galvanické články se dají znovu nabít a použít opakovaně. Patří k nim např. akumulátory (autobaterie – olověný akumulátor, baterie do mobilních telefonů). Elektrochemické reakce zde probíhají oběma směry. |
| Olověný akumulátor
Skládá se:
vybíjení Pb + PbO2 + 2H2SO4 —> 2 PbSO4 + 2 H2O nabíjení – reakce probíhá obráceně |
Na co umět odpovědět:
|
CITACE: viz. odkaz: [k. 1 – chemie], [k. 2 – chemie]
obrázek (baterie): http://oxel.blog.cz/
