Kyselost a zásaditost vodných roztoků
Kyselost roztoku – způsobují vodíkové kationy H+ (oxoniové kationy H3O + ).
Zásaditost roztoku – způsobují hydroxidové anionty OH- .
Míru kyselosti nebo zásaditosti roztoku udává stupnice pH (stupnice od 0 do 14).
Podle hodnoty pH rozdělujeme roztoky na:
- kyselé (mají pH < 7) –
- neutrální (mají pH = 7)
- zásadité (mají pH > 7)
čím je hodnota pH kyselého roztoku nižší, tím je roztok kyselejší
čím je hodnota pH kyselého roztoku vyšší, tím je roztok zásaditější
Indikátory
Indikátory – jsou to organické látky, které mění barvu v závislosti na prostředí (kyselé, neutrální, zásadité). Slouží ke zjištění kyselosti nebo zásaditosti roztoků.
Příklady indikátorů:
- Lakmus – přechází z kyselé červené formy na zásaditou modrou
- Fenolftalein – přechází z kyselé bezbarvé formy na zásaditou fialovou v oblasti pH 8,0–9,8
- Methyloranž – přechází z kyselé oranžové formy na zásaditou žlutou v oblasti pH 3,1–4,5
- Methylčerveň – přechází z kyselé červené formy na zásaditou žlutou v oblasti pH 4,4–6,3
- Bromthymolová – modř přechází z kyselé žluté formy na zásaditou modrou v oblasti pH 6,0–7,6
Některé indikátory lze připravit doma: šťáva z červeného zelí, z červené řepy, z borůvek
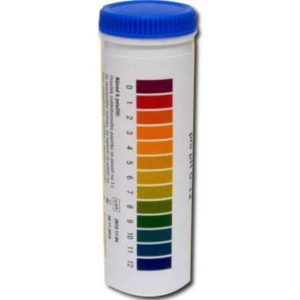
K měření pH většinou používáme univerzální indikátorové papírky.
K přesnému měření hodnoty pH v chemických laboratořích slouží elektronické přístroje tzv. pH-metry.

Josef MACH, Irena PLUCKOVÁ, Jiří ŠIBOR: Chemie pro 8. ročník – Úvod do obecné a anorganické chemie, 3. vyd. Brno: Nová škola, s. r. o., 2014. ISBN 978-80-7289-543-4
obrázek (indikátorové papírky): https://www.pivoteka.cz/ph-test-indikacni-papirky-universalni-tuba-7301?gclid=EAIaIQobChMI5sj5vv-p1QIVKyrTCh3xvgxYEAkYASABEgIiJvD_BwE
obrázek (pH metr): https://www.mall.cz/ph-metry/voltcraft-ph-100-atc?gclid=EAIaIQobChMIxua2ooCq1QIVab7tCh2v4AmzEAQYBSABEgIStvD_BwE&dclid=CNyWn6qAqtUCFU8S0wodlCQJMQ
