Molární hmotnost
Molární hmotnost – je fyzikální veličina která udává jakou hmotnost má 1 mol látky.
Značka: M
Základní jednotka: kg/mol (kilogram na mol)
Další jednotky:
gram na mol (1 g·mol-1 = 0,001 kg·mol-1)
kilogram na kilomol (1 kg·kmol-1 = 0,001 kg·mol-1)
Výpočet:
n ….. látkové množství
m ….. hmotnost
M ….. molární hmotnost
Molární hmotnosti atomů jednotlivých prvků nalezneme v matematicko-fyzikálních tabulkách.
Molární hmotnost sloučeniny určíme z jejího vzorce tak, že sečteme molární hmotnosti všech atomů jednotlivých prvků.
Příklad 1: Vypočítejte molární hmotnost NH3.
Postup:
- z matematicko-fyzikálních tabulek zjistíme molární hmotnost N, H
M (N) = 14 g/mol
M (H) = 1 g/mol
- poté vypočteme molární hmotnost NH3
M (NH3) = M (N) + 3 . M (H) = 14 + 3 . 1 = 17 g/mol
- Odpověď: molární hmotnost amoniaku je 17 g/mol.
Příklad 2: Vypočítejte hmotnost 2 molů hydroxidu sodného (NaOH)
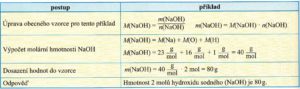
Příklad 2: Vypočítejte kolik molů odpovídá 100 g hydroxidu sodného (NaOH).

Josef MACH, Irena PLUCKOVÁ, Jiří ŠIBOR: Chemie pro 8. ročník – Úvod do obecné a anorganické chemie, 3. vyd. Brno: Nová škola, s. r. o., 2014. ISBN 978-80-7289-543-4

