Názvosloví solí
Soli bezkyslíkatých kyselin
Mezi soli patří i:
halogenidy – soli bezkyslíkatých kyselin např. kyseliny chlorovodíkové HCl
sulfidy – soli kyseliny sirovodíkové H2S
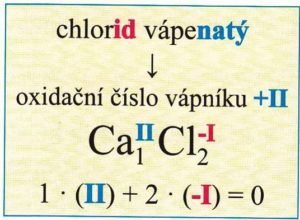
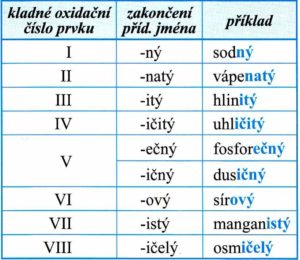
Název halogenidů se skládá z podstatného jména (tvořeno názvem halogenidu a zakončeno -id) a přídavného jména (odpovídá zakončení přídavného jména viz. tab.). Halogen má ve vzorci vždy záporné oxidační číslo -I. Prvek sloučený s halogenem má vždy kladné oxidační číslo (odpovídá zakončení přídavného jména viz. tab.)
Název sulfidů se skládá z podstatného jména (tvořeno názvem sulfid) a přídavného jména (odpovídá zakončení přídavného jména). Síra má ve vzorci vždy záporné oxidační číslo -II. Prvek sloučený s sulfidem má vždy kladné oxidační číslo (odpovídá zakončení přídavného jména viz. tab.)

Soli kyslíkatých kyselin
Kyseliny ve vodě ionizují za odštěpení vodíkových kationtů a aniontů příslušné kyseliny. Ionizace kyselin ve vodě se označuje jako disociace.
Např. H2ISVIO4-II → 2H+ + (SO4)2-
kyselina sírová má ve svém vzorci dva vodíky (ideálně se odštěpí oba dva), pokud se neodštěpí všechny, vznikají anionty hydrogensolí
Vytvoření názvu aniontu pod kyslíkaté kyseliny (podstatné jméno v názvu soli)
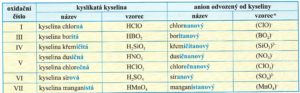
Název soli je vždy dvouslovný. Skládá se z podstatného jména (odvozeného od názvu kyseliny) a přídavného jména (odvozeného od názvu kationtu kovu). Zakončení názvu kationtu určuje jeho oxidační číslo.
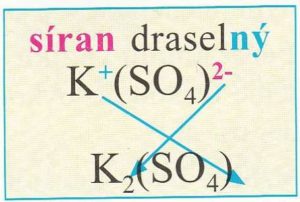
Příklad1: Tvorba vzorce soli z názvu aniontu kyseliny.

Příklad2: Tvorba názvu soli z jejího vzorce výpočtem oxidačních čísel.

Josef MACH, Irena PLUCKOVÁ, Jiří ŠIBOR: Chemie pro 8. ročník – Úvod do obecné a anorganické chemie, 3. vyd. Brno: Nová škola, s. r. o., 2014. ISBN 978-80-7289-543-4
