Hydrogensoli
Ionizace – je rozštěpení molekul na ionty.
Kyseliny které obsahují více vodíkových atomů, mohou při ionizaci postupně odštěpovat vodíkové kationty.
Např. H2CO3 → HCO3– + H+ HCO3– → CO3-II + H+
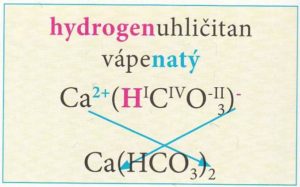
Hydrogensoli – obsahují anionty, ve kterých je jeden nebo více atomů vodíku.
Počet odštěpených kationtů vodíku je shodný s oxidačním číslem vniklého aniontu.
Názvy hydrogensolí obsahují předponu hydrogen- před podstatným jménem názvu soli.
Počet atomů vodíku, které anion hydrogensoli obsahuje, označujeme řeckou číslovkou 1 – mono, 2 – di, 3 – tri ….
Vzorce hydrogensolí tvoříme podobně jako vzorce solí, pouze připíšeme vodík před první prvek aniontu.
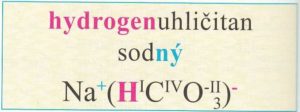
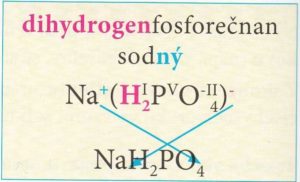
Příkladem hydrogensoli je hydrogenuhličitan sodný (jedlá soda).
Josef MACH, Irena PLUCKOVÁ, Jiří ŠIBOR: Chemie pro 8. ročník – Úvod do obecné a anorganické chemie, 3. vyd. Brno: Nová škola, s. r. o., 2014. ISBN 978-80-7289-543-4
