Obal atomu
(výpisek z učebnice a jiné zajímavosti pro žáky k probíranému tématu)
- je tvořen prázdným prostorem, ve kterém se pohybují elektrony (e–)
- v porovnání s protony a neutrony mají elektrony zanedbatelnou hmotnost
- elektrony se pohybují v obalu v různých vzdálenostech od jádra v tzv. elektronových vrstvách
- v jednotlivých elektronových vrstvách mají elektrony různou energii
- vrstev může být maximálně 7
- poslední vrstva, nejvzdálenější od jádra, je tzv. valenční vrstva
- elektrony ve valenční vrstvě označujeme jako valenční elektrony (mají nejvyšší energii)
- počet elektronů v jednotlivých elektronových vrstvách každého atomu je přesně stanoven
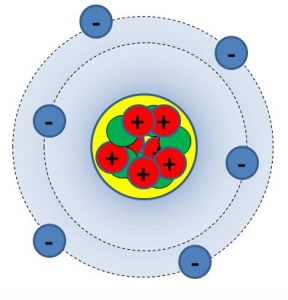
model atomu uhlíku
Elektronová konfigurace (pro zajímavost)
- popisuje uspořádání elektronů uvnitř elektronového obalu
- předpokládá se, že se elektrony převážně vyskytují v prostoru, který se nazývá atomový nebo molekulový orbital
- nejčastěji se používá zápis ve stylu nxe, kde n je číslo slupky, x je číslo podslupky a e je počet elektronů v podslupce
- jednotlivé orbitaly se zapisují v pořadí vzrůstající energie
- zaplňují se v následujícím pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p …
Např. základní stav atomu fosforu zapíšeme takto: 1s2 2s2 2p6 3s2 3p3.
Protože je zápis fosforu velmi dlouhý, uvedeme nejbližší vzácný plyn s nižším protonovým číslem a poté zapíšeme elektrony, které má prvek navíc, zápis potom vypadá takto [Ne] 3s2 3p3.
Na co umět odpovědět:
|
CITACE: viz. odkaz [k. 3 – chemie], [int. 36 – elektronová konfigurace]
